Nomenclatura de alcoholes
Los alcoholes son compuestos orgánicos formados a partir de los hidrocarburos
mediante la sustitución de uno o más grupos hidroxilo por un número igual de
átomos de hidrógeno. El término se hace también extensivo a diversos
productos sustituidos que tienen
carácter neutro y que contienen uno o más grupos alcoholes.
Regla 1. Se
elige como cadena principal la de mayor longitud que contenga el grupo -OH.
Regla
2. Se numera la cadena principal para que el grupo -OH tome el
localizador más bajo. El grupo hidroxilo tiene preferencia sobre cadenas
carbonadas, halógenos, dobles y triples enlaces.
Regla
3. El nombre del
alcohol se construye cambiando la terminación -o del alcano con igual número de
carbonos por -ol
Regla
4. Cuando en la
molécula hay grupos grupos funcionales de mayor prioridad, el alcohol pasa a
serun mero sustituyente y se llama hidroxi-. Son prioritarios frente a los alcoholes: ácidos carboxílicos,
anhídridos, ésteres, haluros de alcanoilo, amidas, nitrilos, aldehídos y
cetonas.
Regla
5. El grupo -OH es
prioritario frente a los alquenos y alquinos. La numeración otorga el
localizador más bajo al -OH y el nombre de la molécula termina en -ol.
Reacciones de alcoholes
Las reacciones de alcoholes son
aquellas reacciones que son específicas para el grupo funcional alcohol. Se
clasificarán en:
-Intercambios de grupo funcional (-OH →
-X).
-Formación de enlaces C-O-C.
-Formación de enlaces carbono-carbono
(C-OH → C-C).
Intercambios de grupo funciona:
Oxidaciones
La oxidación de alcoholes es
una reacción orgánica importante. Los alcoholes primarios (R-CH2-OH) pueden
ser oxidados a aldehídos (R-CHO) o ácidos carboxílicos (R-COOH), mientras que la
oxidación de alcoholes secundarios (R1R2CH-OH),
normalmente termina formando cetonas (R1R2C=O). Los alcoholes terciarios
(R1R2R3C-OH) son resistentes a la oxidación.1
a) La oxidación directa de los alcoholes primarios a ácidos
carboxílicos: normalmente transcurre a través del correspondiente
aldehído, que luego se transforma por reacción con agua en un hidrato
de aldehído (R-CH(OH)2), antes de que pueda ser oxidado a
ácido carboxílico.
A menudo es posible interrumpir la
oxidación de un alcohol primario en el nivel de aldehído mediante la
realización de la reacción en ausencia de agua, de modo que no se puedan formar
hidratos de aldehído.
b) Oxidación de alcoholes a aldehídos:
Los reactivos útiles para la
transformación de alcoholes primarios en aldehídos normalmente también son
adecuados para la oxidación de alcoholes secundarios en cetonas. Estos
incluyen:
·
Reactivos
a base de cromo, tales como reactivo de Collins (CrO3·Py2;
donde Py= piridina), PDC o PCC.
·
DMSO activado, que resulta de la
reacción de DMSO con electrófilos, como el cloruro de oxalilo (oxidación de Swern), una carbodiimida (oxidación
de Pfitzner-Moffatt) o el
complejo SO3·Py (oxidación de Parikh-Doering).
·
Compuestos
de yodo hipervalente, como peryodinano de Dess-Martin o el ácido 2-yodoxibenzoico (ácido IBX).
Los alcoholes alílicos y
bencílicos pueden ser oxidados en presencia de otros alcoholes con ciertos
oxidantes selectivos, tales como dióxido de manganeso (MnO2).
c) Oxidación de alcoholes a cetonas:
Entre los reactivos útiles para la
oxidación de alcoholes secundarios a cetonas, pero por lo general ineficaces
para la oxidación de alcoholes primarios a aldehídos, se incluyen el trióxido de cromo (CrO3) en una
mezcla de ácido sulfúrico y acetona (oxidación de Jones), y ciertas cetonas, como por ejemplo la ciclohexanona,
en presencia de isopropóxido
de aluminio (oxidación de Oppenauer). Otro método es la oxidación catalizada por oxoamonio.
d) Oxidación de alcoholes a ácidos carboxílicos:
La oxidación directa de los alcoholes
primarios a ácidos carboxílicos puede llevarse a cabo mediante:
e) Oxidación a dio les ==
Los alcoholes que poseen dos
grupos hidroxilo situados en carbonos
adyacentes, es decir, los 1,2-dioles, sufren la ruptura oxidativa de
un enlace carbono-carbono con algunos oxidantes como el per yodato de sodio (NaIO4) o el tetra acetato de plomo (Pb(OAc)4),
propiciando la generación de dos grupos carbonilo. La reacción también es conocida como ruptura del glicol.2
Esterificaciones con ácidos minerales
Los alcoholes pueden formar ésteres con
ácidos inorgánicos (como el ácido sulfúrico, ácido nítrico o ácido fosfórico) o sus respectivos cloruros de
acilo (Cloruro de fosforillo, cloruro de sulfurillo o fosgeno)
Biológicamente, las quinasas (EC 2.7.1.-)
son enzimas que transfieren grupos fosfato a grupos alcohol:
Formación de halogenuros de alquilo a partir de alcoholes
a) Fluoraciones (X = F): Se pueden obtener fluoruros
de alquilo por acción del piridina y fluoruro de hidrógeno (Reactivo de Olah). En vez de fluoruro de hidrógeno pueden ser
utilizados varios agentes flourantes, como el trifluoruro de dietilaminoazufre (DAST), SF4, SeF4,TsF,
CsI/BF3.
b)Cloraciones
(X = Cl): Se pueden obtener cloruros de alquilo por la acción de
varios reactivos, tales como ácido clorhídrico (HCl) para alcoholes
terciarios y en presencia de cloruro de zinc para alcoholes secundarios y primarios; cloruro de tionilo, cloruro fosfórico (PCl3) cloruro fosforoso (PCl3) y cloruro de fosforilo. El ácido
tricloroisocianúrico (1,3,5-triclorohexahidrotriazin-2,4,6-triona) y
trifenilfosfina convierten alcoholes primarios en cloruros de alquilo
primarios.
c) Bromaciones
(X = Br): Se pueden obtener bromuros de alquilo por la acción de
varios reactivos, tales como ácido bromhídrico (HBr), bromuro de tionilo, bromuro fosfórico (PBr3) bromuro fosforoso (PBr3) y bromuro de fosforilo.
d)
Yodaciones (X = I): Se puede emplear ácido yodhídrico, o yoduro de potasio en ácido fosfórico. El uso de HI puede reducir el yoduro de alquilo al alcano correspondiente y si el sustrato
es insaturado puede saturarse
Estas reacciones puede ser utilizadas
para preparar halogenuros de alquilo primarios, secundarios y terciarios, pero
los alcoholes neopentílicos muchas veces pueden transponer.
Deshidratación de alcoholes
La deshidratación de alcoholes es
el proceso químico que consiste en la transformación de un alcohol para poder
ser un alqueno por procesos de eliminación. Para realizar este procedimiento se
utiliza un ácido mineral para extraer el grupo
hidroxilo (OH) desde el alcohol, generando una carga positiva en el carbono del
cual fue extraído el Hidroxilo el cual tiene una interacción eléctrica con los
electrones más cercanos (por defecto, electrones de un hidrógeno en el caso de
no tener otro sustituyente) que forman un doble enlace en su lugar.
Por esto, la deshidratación de alcoholes es útil,
puesto que fácilmente convierte a un alcohol en un alqueno.
Un ejemplo simple es la síntesis del ciclo hexeno
por deshidratación del ciclohexanol. Se puede ver la acción del ácido (H2SO4) ácido sulfúrico el cual quita el grupo
hidroxilo del alcohol, generando el doble enlace y agua.
Formación de enlaces C-O-C
Alquilación
de alcoholes
1) Deshidratación
de alcoholes
Nombre de acuerdo al sistema de March: Alcoxi-deshidroxilación
La deshidratación de alcoholes para formar éteres simétricos puede
llevarse a cabo con un ácido que funcione como deshidratante, tal como el ácido sulfúrico.12 El mecanismo de reacción consiste en:
a) Protonación del alcohol
b) Sustitución nucleó fila,
dependiendo si el alcohol es primario (Reacción SN2), secundario o
terciario (Reacción SN1).
Un
mecanismo alternativo propone la formación del mono éster sulfúrico, y así se
forma sulfato como grupo saliente. Se pueden mejorar los rendimientos en el
caso de diarilcarbinoles (ArAr'CHOH) con ácido tosí lico en estado sólido. Otros deshidratantes utilizados puede
ser el Nafion con siliéteres, y ácidos de Lewis (p. ejem. MeAl(NTf)2)con
algunos alcoholes.
Los 1,4-dioles y los 1,5-dioles forman compuestos heterocíclicos.
Los dio les vecinales pueden formar epóxidos:
Nombre de acuerdo al sistema de March: Hidro, alcoxi-desdiazo-bisustitución
Los alcoholes reaccionan con días o compuestos para formar éteres,
pero el diaz o metano y las Díaz o cetonas reaccionan con mayor facilidad,
produciendo así metil éteres ó α-ceto éteres respectivamente Con diaz o metano el método es costoso y requiere
precauciones, pero las condiciones son moderadas y
tiene altos rendimientos. El diaz
o metano por lo general es utilizado para metilar alcoholes que pueden
presentar reacciones indeseadas. Los alcoholes ordinarios reaccionan en
presencia de catalizadores tales como HBF4 (HF/BrF3) ó sílica gel.
3) Alcohólisis de
acridinas y epóxidos
Nombre de acuerdo al sistema de March: (3)OC-seco-alcoxi-desalcoxilación
En esta reacción puede utilizarse ácido sulfúrico, ácido fosfórico, bromuro de flúor y otros ácido de Lewis o alúmina. Puede ocurrir por mecanismo Reacción SN1 ó Reacción SN2.
También se han reportado catalizadores de [Rh(CO)2Cl]2, TiCl3(OTf) Fe(ClO4)3, Cu(BF4)2.n H2O, o BiCl3.
4) Adición de
alcoholes a alquenos
Nombre de acuerdo al sistema de March: Hidro-alcoxi-adición
La adición de alcoholes a dobles ligaduras puede ser catalizada
por ácidos. El mecanismo es electrofílico, en donde el enlace π es atacado por
el protón ácido. Al formarse el carbocatión, el alcohol se adiciona por el
mecanismo de SN. La adición sigue la Regla de Markovnikov. Los alcoholes primarios
dan mejores resultados que los secundarios y los alcoholes terciarios son muy
inactivos. La adición de alcoholes a sistemas alílicos puede proceder con
transposición y el uso de un aditivo quiral puede llevar a una inducción
asimétrica. La adición
intramolecular de alcoholes a alquenos puede ser promovida por un catalizador
de paladio, en donde la doble ligadura puede migrar en el producto final. Los compuestos de renio, de titanio o de platino facilitan la ciclización de anillos de
tetrahidrofurano. Los alcoholes alílicos se pueden convertir en 2-bromooxetanos
empleando Br (colidina)2+ PF6.
Formación
de cetales
Los acetales y cetales se preparan a partir de la acetona o aldehído
correspondiente y un alcohol, en presencia de ácido mineral. La reacción está
en equilibrio marcado, así que se utilizan condiciones que favorezcan la
formación del producto acetálico, por ejemplo, haciendo uso de la ley de acción
de masas. El mecanismo de formación de acetales se cataliza con medio ácido.
Esta reacción es en dos etapas, llevadas a cabo en el mismo reactor. En la
primera, el compuesto carboxílico reacciona con una cantidad equivalente de
alcohol, en un equilibrio ácido-base por un mecanismo de adición-eliminación
para formar un hemiacetal (o hemicetal, según sea aldehído o cetona). El
hemiacetal se protona posteriormente para formar el acetal otra vez por un
mecanismo adición-eliminación.
Esterificaciones
carboxílicas
a) Esterificación de
Fischer-Speier: La esterificación de Fischer-Speier o
esterificación de Fischer es un tipo especial de esterificación que consiste en
la formación de un éster por reflujo de un ácido carboxílico y un alcohol, en
presencia de un catalizador ácido. La reacción fue descrita por vez primera por
Emil Fischer y Arthur Speier en 1895.1 La mayoría de ácidos carboxílicos son
aptos para la reacción, pero el alcohol debe ser generalmente un alcohol
primario o secundario. Los alcoholes terciarios son susceptibles a la
eliminación, y los fenoles suelen ser muy poco reactivos para dar rendimientos
útiles. Los catalizadores más comúnmente usados para una esterificación de
Fischer incluyen al ácido sulfúrico, ácido tosílico y un ácido de Lewis como el triflato de escandio
(III).
b) Esterificación de
Schotten-Bauer:
c) Esterificación con anhídridos
carboxílicos:
d) Esterificación por
carbonilación:
Nombre de acuerdo al sistema de March: Alcoxicarbonil-deshalogenación
Varios métodos, basados en el empleo del monóxido de carbono o carbonilos metálicos, han sido desarrollados por conversión de
halogenuros de alquilo en presencia de un alcohol para formar ésteres. Las condiciones más empleadas son en
presencia de pentacloruro de antimonio y bióxido de azufre. El cloruro de
antimonio promueve la formación del carbocatión y el par electrónico del
carbeno del monóxido de carbono lo ataca. El alcohol ataca al carbonilo
correspondiente.
De manera similar, los alcoholes terciarios reaccionan con H2SO4 y monóxido de carbono para producir
ácidos acéticos trisustituidos de acuerdo al procedimiento de Koch-Haaf. Si
un alcohol primario o secundario es el sustrato, puede sufrir transposición.
Los yodo alcoholes pueden formar lactonas en presencia de iniciadores de
radicales libres (AIBN, tributil alil estannano) (Alil-SnBu3) y 45
atm de CO.
La reacción de
Mitsunobu es
una reacción orgánica que convierte un alcohol en una diversidad de grupos
funcionales, tales como un éster,
usando trifenilfosfina y azodicarboxilato de
dietilo(DEAD). El alcohol sufre una inversión de su estereoquímica.
e) Formación
de carbamatos
Se pueden preparar carbamatos empleando alcoholes y un isociatato de
alquilo. Es una reacción de amplio espectro y que produce buenos rendimientos.
La adición de un segundo equivalente produce un alofanato.
Formación de enlaces carbono-carbono (C-OH → C-C)
Acoplamiento
de alcoholes con organometálicos
Nombre de acuerdo al sistema de March: Deshidroxil-acoplamiento
En algunos casos es posible acoplar un alcohol con un compuesto
organometálico. Los alcoholes alílicos se acoplan con bromuros de
alquilmagnesio en la presencia de tetraisopropóxido de titanio (M = Ti) Los alcoholes alílicos también se
pueden acoplar con ácidos arilborónicos solvente iónico líquido y un
catalizador de rodio. El
acoplamiento de un alcohol al carbono α de una alquilmetilcetona da un alcohol
β-sustituido.
Los
alcoholes alílicos o bencílicos pueden ser simétricamente acoplados por
tratamiento con metil litio y cloruro de titanio (III) a -78ºC o con cloruro de
titanio (III) e hidruro de litio y
aluminio. Si el
sustrato es un alcohol alílico, la reacción no es regio específica. Los 1,3-dioles se pueden convertir en ciclo propanos por esta
reacción
Producción de alcoholes
La fermentación es un proceso
metabólico energético que comprende la descomposición de moléculas, tales como
carbohidratos, de manera anaerobia. La fermentación ha sido utilizada desde
tiempos antiguos en la preparación de alimentos y bebidas. El desarrollo
químico ha revelado la naturaleza biológica del proceso de fermentación. El
producto de la fermentación es el alcohol etílico, pequeñas cantidades de
propanol, butanol, ácido acético, y ácido láctico; los alcoholes de alta
concentración también se pueden formar. El alcohol etílico está familiarizado
con las bebidas alcohólicas. En su forma no natural es usado como un solvente
industrial y como materia prima para la manufactura de acetaldehído, acetato
etílico, ácido acético, dibromito de etileno, glicol y muchos otros químicos
orgánicos. El alcohol puro también puede ser utilizado para propósitos
medicinales, farmacéuticos y saborizantes.
La fermentación del alcohol etílico es
realizada en forma cerrada por cualquier carbohidrato rico en substratos. La
melaza, licor producido de desechos, permanecen después de la cristalización de
la sucrosa y es usada ampliamente como materia prima en la fermentación
alcohólica. La melaza blackstrapcontiene 35-40% de sucrosa y 15-20%
de azúcares invertidos (glucosa y fructuosa) La melaza hightest contiene
21-22% de sucrosa y 50-55% de azúcares invertidos. La mayoría de las
melazas blackstrap no requieren otros nutrientes adicionales
para realizar la fermentación del alcohol etílico. Sin embargo, las
melazas hightest requieren cantidades considerables de sulfato
de amonio y otras sales, como fosfatos. El contenido de nutrientes no
azucarados de 50-lidsde las melazas hightest es
aproximadamente 7%, comparado con el 28-35% encontrado en las melazas blackstrap.
El alcohol etílico también puede ser
producido por fermentación del almidón, suero o licor de desechos de sulfito.
La fermentación de granos requiere un pre tratamiento dado que la levadura no
puede metabolizar directamente el almidón. Los granos (usualmente el maíz) son
agrupados y calentados en una lechada acuosa para gelatinizar o solubilizar el
almidón. Algunas enzimas líquidas pueden ser añadidas a bajas temperaturas. El
almidón líquido es enfriado alrededor de 65°C y tratado con amilasa de malta o
de hongos para convertir el almidón en oligosacáridos. Luego, la levadura es
añadida junto con amiloglucosidasa (o glucoamilasa) los cuales convierten los
oligosacáridos en glucosa. El proceso de fermentación y refinación posteriores
son los mismos que se realizan cuando se usa melaza como materia prima.
La producción del alcohol etílico es
realizada a través de procesos eficientes y automáticos. El proceso de
manufactura no es muy complejo y es fácil de realizar. El control de la
contaminación y el mantenimiento y reparación de las maquinarias y equipos
también son fáciles. Aquellas naciones con climas tropicales y sub-tropicales,
con abundante producción de azúcar y maíz, podrían invertir en el
establecimiento de esta planta de producción que puede ser orientada tanto a la
exportación como a la importación.
DESCRIPCIÓN DEL PROCESO.
1. Transporte y almacenamiento de la melaza: La melaza obtenida desde una
fábrica proveedora es transportada vía transferencia de tuberías o carros de
almacenamiento a la planta de procesamiento de alcohol etílico. La melaza es
colocada en un tanque de almacenamiento de concreto bajo tierra por bombeo de
la melaza. Cuando el proceso ha comenzado, la melaza almacenada será bombeada
en un contenedor o vasija de disolución para ajustarlo a una concentración
adecuada.
2. Preparación de la melaza: La melaza es bombeada dentro del tanque
medidor a través de un bombeo desde el tanque bajo tierra el cual recibe el
material directamente desde el tanque de almacenamiento por transferencia de
tuberías. Después que la melaza es medida exactamente, fluye hacia el tanque de
disolución de la melaza. Debido a su resistente concentración de azúcar, la
melaza no soporta una fermentación directa, por lo tanto primero debe ser
diluido a la concentración deseada. Este es llamado masa o templa, y presenta
los carbohidratos listos para la inoculación o vacunación de los cultivos de
semillas. La melaza utilizada en este proceso no necesita ser esterilizada o
“nutriotinizada” por un proceso diseñado especialmente, el cual será útil para
eliminar el consumo de vapor y los costos de producción de corte. Después que
la melaza es diluida a la concentración deseada, una mezcladora automática
ayudará a darle una concentración homogénea para el proceso de fermentación,
antes de que sea bombeado a una serie de fermentadores de acero.
3. Estación de cultivo de granos: La estación es equipada con un
fermentador piloto en conjunto con el equipo de cultivo de granos y los
instrumentos de cultivo diseñados especialmente. Este proceso es realizado bajo
una exacta supervisión de laboratorio, incluyendo la selección de la
inoculación de los granos de levadura, la adición de nutrientes, el ajuste del
pH, el control de temperatura, y finalmente la limpieza y esterilización de la
máquina de cultivo de levadura para la realización del siguiente lote.
4. Suministro de agua procesada: El equipo suministrador de agua procesada
y el equipo incrementador de presión son proporcionados. El suministro de agua
procesada será diseñado para una carga máxima de 21 TM/Hr; sin embargo, sólo
aproximadamente 210 TM es necesario diariamente. El agua utilizada en el
proceso podría ser tratada como agua drenada de calidad o suministrado por un
pozo de 90-100 metros de profundidad.
5. Estación de fermentación: Existen 8 fermentadores con una capacidad
aproximada de 45 KL. Los fermentadores están conectados por tuberías para una
operación de fermentación continua. Esta estación tiene un control automático de
temperatura, velocidad de flujo, operación de templado y operación de
alimentación. Usualmente el ciclo de fermentación dura de 2-3 días. Dado que el
alcohol etílico es formado por levadura desde monosacárido, es necesario
descomponer la sucrosa en d-glucosa y d-fructuosa. Las enzimas producidas por
la levadura cambian los monosacáridos en alcohol y dióxido de carbono. Después
que ha sucedido la reacción, el alcohol etílico presente en los fermentadores
puede ser separado por destilación. El contenido de alcohol de la masa es de
7-12% de su volumen, es bombeada hasta la sección de destilación del alcohol.
Después de pasar a través de varios intercambiadores de temperatura, el residuo
en la base del destilador transporta proteínas, residuos de azúcar y otras
impurezas que pueden ser extraídas y usadas como componentes para alimento
animal. El diseño de la estación elimina los errores de operación y puede
alcanzar resultados efectivos a bajos costos de operación. La capacidad de esta
estación puede presentar el requerimiento para la manufactura suficiente del
caldo fermentado para la estación de destilación con una producción diaria de
30 KL de alcohol etílico.
6. Estación de destilación y rectificación: El caldo conteniendo alcohol
etílico, agua, aldehido, ácido acético, etc. , pasa a través de un
intercambiador de temperatura hacia un condensador parcial para mantener el
alcohol en la columna y para proporcionar un reflujo para las placas
superiores. Los productos más volátiles, los cuales todavía pueden contener
rastros de aldehidos y alcohol, son condensados completamente y transportados
detrás de la parte superior del destilador de aldehido. Cerca de la parte
superior de la columna, el 95-96% del alcohol es absorbido a través del
condensador para su almacenamiento.
Uso de alcoholes
Los alcoholes tienen una gran gama de usos en la industria y en la
ciencia como disolventes y combustibles.
El etanol y el metanol pueden hacerse combustionar de una
manera más limpia que la gasolina o el gasoil. Por su baja toxicidad y
disponibilidad para disolver sustancias no polares, el etanol es utilizado
frecuentemente como disolvente en fármacos, perfumes y en esencias vitales como la vainilla.
Los alcoholes sirven frecuentemente como versátiles intermediarios en la síntesis orgánica.
Alcohol de botiquín
El
alcohol de botiquín puede tener varias composiciones. Puede ser totalmente alcohol etílico al 96º, con algún aditivo como el cloruro de
benzalconio o
alguna sustancia para darle un sabor desagradable. Es lo que se conoce como alcohol etílico desnaturalizado.
También se utilizan como desnaturalizantes el ftalato de dietilo y el metanol,
lo cual hace tóxicos a algunos alcoholes desnaturalizados.
Otras
composiciones: podría contener alcohol isopropílico, no es apto para beber,
pero puede ser más efectivo para el uso como secante.
Propiedades de los alcoholes
Propiedades
generales
Los alcoholes suelen ser líquidos incoloros de olor característico, solubles en el agua en proporción variable y
menos densos que ella. Al aumentar la masa
molecular, aumentan sus puntos de fusión y ebullición, pudiendo ser sólidos a
temperatura ambiente (p.e. el pentaerititrol funde a 260 °C). A diferencia
de los alcanos de los que derivan, el grupo funcional hidroxilo permite que la
molécula sea soluble en agua debido a la similitud del grupo hidroxilo con la
molécula de agua y le permite formar enlaces de hidrógeno. La
solubilidad de la molécula depende del tamaño y forma de la cadena alquílica,
ya que a medida que la cadena alquílica sea más larga y más voluminosa, la
molécula tenderá a parecerse más a un hidrocarburo y menos a la molécula de
agua, por lo que su solubilidad será mayor en disolventes apolares, y menor en
disolventes polares. Algunos alcoholes (principalmente polihidroxílicos y con anillos
aromáticos) tienen una densidad mayor que la del agua.
El hecho de que el grupo hidroxilo pueda formar enlaces de
hidrógeno también afecta a los puntos de fusión y ebullición de los alcoholes.
A pesar de que el enlace de hidrógeno que se forma sea muy débil en comparación
con otros tipos de enlaces, se forman en gran número entre las moléculas,
configurando una red colectiva que dificulta que las moléculas puedan escapar
del estado en el que se encuentren (sólido o líquido), aumentando así sus
puntos de fusión y ebullición en comparación con sus alcanos correspondientes.
Además, ambos puntos suelen estar muy separados, por lo que se emplean
frecuentemente como componentes de mezclas anticongelantes. Por ejemplo, el
1,2-etanodiol tiene un punto de fusión de -16 °C y un punto de ebullición
de 197 °C.
Propiedades
químicas de los alcoholes
Los alcoholes pueden comportarse como ácidos o bases gracias a que
el grupo funcional es similar al agua, por lo que se establece un dipolo muy parecido al que
presenta la molécula de agua.
Por un lado, si se enfrenta un alcohol con una base fuerte o con
un hidruro de metal alcalino se forma el grupo alcoxi,
en donde el grupo hidroxilo se desprotona dejando al oxígeno con carga
negativa. La acidez del grupo hidroxilo es similar a la del agua, aunque
depende fundamentalmente del impedimento estérico y del efecto inductivo.
Si un hidroxilo se encuentra enlazado a uncarbono terciario,
éste será menos ácido que si se encontrase enlazado a un carbono secundario, y a su vez éste sería menos ácido
que si estuviese enlazado a un carbono primario, ya que el impedimento estérico impide que la molécula se sol vate de manera efectiva. El
efecto inductivo aumenta la acidez del alcohol si la molécula posee un gran
número de átomos electronegativos unidos a carbonos adyacentes (los átomos
electronegativos ayudan a estabilizar la carga negativa del oxígeno por
atracción electrostática).
Por otro lado, el oxígeno posee 2 pares electrónicos no
compartidos por lo que el hidroxilo podría protonarse, aunque en la práctica
esto conduce a una base muy débil, por lo que para que este proceso ocurra, es
necesario enfrentar al alcohol con un ácido muy fuerte.
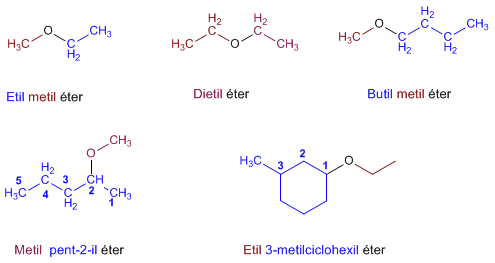
Nomenclatura de éteres
Regla 1. Los
éteres pueden nombrarse como alcoxi derivados de alcanos (nomenclatura IUPAC
sustitutiva). Se toma como cadena principal la de mayor longitud y se nombra el
alcóxido como un sustituyente.
Regla 2. La nomenclatura funcional (IUPAC) nombra los éteres como derivados de dos grupos alquilo, ordenados alfabéticamente, terminando el nombre en la palabra éter.
Regla 3. Los éteres cíclicos se forman sustituyendo un -CH2- por -O- en un ciclo. La numeración comienza en el oxígeno y se nombran con el prefio oxa- seguido del nombre del ciclo.

Reacción de éteres
Ruptura
por HBr y HI
Auto
oxidación
Uso de los éteres
·
Medio para extractar para concentrar ácido acético y otros ácidos.
·
Medio de arrastre para la deshidratación de alcoholes etílicos e
isopropílicos.
·
Disolvente de sustancias orgánicas (aceites, grasas, resinas,
nitrocelulosa, perfumes y alcaloides).
·
Combustible inicial de motores Diésel.
·
Fuertes pegamentos
·
Anti inflamatorio abdominal para después del parto, exclusivamente
uso externo.
Propiedades fisicas de los éteres
Los éteres presentan unos puntos de ebullición
inferiores a los alcoholes, aunque su solubilidad en agua es similar.
Dada su importante estabilidad en medios básicos, se emplean como
disolventes inertes en numerosas reacciones.
La importante solubilidad en agua se explica por los puentes de
hidrógeno que se establecen entre los hidrógenos del agua y el oxígeno del
éter.
Propiedades químicas de los éteres
Los éteres tienen
muy poca reactividad química, debido a la dificultad que presenta la ruptura
del enlace C-O. Por ello, se utilizan mucho como
disolventes inertes en reacciones orgánicas. En contacto con el aire sufren una
lenta oxidación en la que se forman peróxidos muy inestables y poco volátiles.
Estos constituyen un peligro cuando se destila un éter; pues se concentran en
el residuo y pueden dar lugar a explosiones. Esto se evita guardando el éter
con hilo de sodio o añadiendo una pequeña cantidad de un reductor (so4fe, LiAlH4) antes de la destilación.
Nomenclatura de esteres
Los ésteres proceden de condensar ácidos con alcoholes y se
nombran como sales del ácido del que provienen. La nomenclatura IUPAC cambia la
terminación -oico del ácido por -oato, terminando con el nombre del grupo alquilo
unido al oxígeno.
Los esteres son grupos prioritarios frente a aminas, alcoholes, cetonas, aldehídos, nitrilos, amidas y haluros de alcanoilo. Estos grupos se nombran como sustituyentes siendo el éster el grupo funcional.

Ácidos carboxílicos y anhídridos tienen prioridad sobre los ésteres, que pasan a nombrarse como sustituyentes (alcoxicarbonil......)

Cuando el grupo éster va unido a un ciclo, se nombra el ciclo como cadena principal y se emplea la terminación -carboxilato de alquilo para nombrar el éster.

Reacción de esteres
Ruptura
por HBr y HI
Autooxidación
Producción de esteres
La industria química produce grandes cantidades de ésteres,
centenares de millones de kilogramos por año. Son de especial importancia los
ésteres de glicerol, el acetato de
etilo, el acetato de butilo, el ftalato de dibutilo, el acetato de celulosa, el xantogenato de celulosa,
el trinitrato de
glicerilo, el acetato de
vinilo y el nitrato de celulosa.
El salicilato de metilo es un éster que se emplea
principalmente como agente aromatizante y posee la ventaja de que se absorbe a
través de la piel. Una vez absorbido,
el salicilato de metilo puede hidrolizarse a ácido salicílico, el cual actúa como analgésico. Este producto
puede extraerse de varias plantas medicinales.
El ácido acetilsalicílico o aspirina, como es conocido
comercialmente, es el más popular de los medicamentos sintéticos, debido a su
acción analgésica, antipirética, anti-inflamatoria yantirreumática,
y por ser utilizado en la prevención y tratamiento del infarto agudo al miocardio,
además de su bajo coste.
La benzocaína o p-aminobenzoato de etilo es un anestésico local, empleado como
calmante del dolor, obtenido también por esterificación.
Uso de los esteres
Los ésteres son empleados en muchos y variados
campos del comercio y de la industria, como los siguientes:
- Disolventes
Los ésteres de bajo peso
molecular son líquidos y se acostumbran a utilizar como disolventes,
especialmente los acetatos de los alcoholes metílico, etílico y butílico.
- Plastificantes
El acetatopropionato de
celulosa y el acetatobutirato de celulosa han conseguido gran importancia como
materiales termoplásticos. El nitrato de celulosa con un contenido de 10,5-11%
de nitrógeno se llama piroxilina y con alcohol y alcanfor (plastificante) forma
el celuloide. El algodón dinamita es nitrato de celulosa con el 12,5-13,5% de
nitrógeno. La cordita y la balistita se fabrican a partir de éste, que se
plastifica con trinitrato de glicerina (nitroglicerina). Los sulfatos de
dimetilo y dietilo (ésteres del ácido sulfúrico) son excelentes agentes de
alcoholización de moléculas orgánicas que contienen átomos de hidrógeno
lébiles, como por ejemplo, el midón y la celulosa.
- Aromas
artificiales
Muchos de los ésteres de
bajo peso molecular tienen olores característicos a fruta: plátano (acetado de
isoamilo), ron (propionato de isobutilo) y piña (butirato de butilo). Estos
ésteres se utilizan en la fabricación de aromas y perfumes sintéticos.
- Aditivos
Alimentarios
Estos mismos ésteres de
bajo peso molecular que tienen olores característicos a fruta se utilizan como
aditivos alimentarios, por ejemplo, en caramelos y otros alimentos que han de
tener un sabor afrutado.
- Productos
Farmacéuticos
Productos de uso tan
frecuente como los analgésicos se fabrican con ésteres.
- Polímeros
Diversos
Los ésteres de los ácidos
no saturados, por ejemplo, del ácido acrílico o metacrílico, son inestables y
se polimerizan rápidamente, produciendo resina; así, el metacrilato de metilo
(lucita o plexiglás). De manera análoga los ésteres de los alcoholes no saturados
son inestables y reaccionan fácilmente con ellos mismos; así, el acetado de
vinilo se polimeriza dando acetato de polivinilo. Las resinas de poliéster,
conocidas como gliptales, resultan de la poliesterificación de la glicerina con
anhídrido ftálico; el proceso puede controlarse de manera que se produzca una
resina fusible o infusible. Cuando la poliesterificación se realiza en
presencia de un ácido no saturado de cadena larga del tipo de los aceites
secantes, la polimerización de éste por oxidación se superpone a la
poliesterificación y se producen los esmaltes sintéticos, duros y resistentes a
la intemperie, que son muy adecuados por el acabado de los automóviles. La
poliesterificación del etilenglicol con el ácido tereftálico produce fibra de
poliéster. Si se da forma de láminas a este material, constituye una excelente
película fotográfica.
- Repelentes
de insectos
Todos los repelentes de insectos que podemos
encontrar en el mercado contienen ésteres.
Propiedades químicas de los esteres
En
las reacciones de los ésteres, la cadena se rompe siempre en
un enlace sencillo, ya sea entre el oxígeno y el alcohol o R, ya sea entre el
oxígeno y el grupo R-CO-, eliminando así el alcohol o uno de sus derivados. La saponificación de los ésteres, llamada así por su
analogía con la formación de jabones, es la reacción inversa a la
esterificación.
Los ésteres se hidrogenan más
fácilmente que los ácidos, empleándose generalmente el éster etílico tratado
con una mezcla de sodio y alcohol (Reducción de Bouveault-Blanc). El hidruro
de litio y aluminio reduce ésteres de ácidos carboxílicos para dar 2
equivalentes de alcohol.2 La reacción es de amplio espectro y se
ha utilizado para reducir diversos ésteres. Las lactonas producen dioles.
Existen diversos agentes reductores alternativos al hidruro de litio y aluminio
como el DIBALH, el trietil-borohidruro de litio o BH3–SiMe3 reflujado con THF.3
El dicloruro de titanoceno reduce los ésteres de ácidos
carboxílicos hasta el alcano (RCH3)y el alcohol R-OH.4 El mecanismo probablemente se debe a
la formación de un alqueno intermediario.
El hidrógeno α de muchos ésteres puede
ser sustraído con una base no nucleofílica o el alcóxido correspondiente al éster. El carbanión
generado puede unirse a diversos sustratos en diversas reacciones de
condensación, tales como la condensación de Claisen , la Condensación de Dieckmann y la síntesis malónica. Muchos métodos de
síntesis de anillos heterocíclicos aprovechan estas propiedades químicas de los
ésteres, tales como la síntesis de pirroles de Hantzsch y la síntesis de Feist-Benary.
Existen reacciones de condensación en las
que se utiliza un reductor que aporte electrones para formar el enlace C-C
entre grupos acilo, como el caso de la condensación aciloínica. Los ésteres
pueden dar alcoholes con dos sustituyentes idénticos por adición de reactivos
de Grignard. Unas aplicación de esta reacción es la reacción de Fujimoto-Belleau.
Propiedades físicas de los esteres
Los
ésteres pueden participar en los enlaces de hidrógeno como aceptadores, pero no pueden
participar como donadores en este tipo de enlaces, a diferencia de los
alcoholes de los que derivan. Esta capacidad de participar en los enlaces de
hidrógeno les convierte en más hidrosolubles que los hidrocarburos de los que derivan. Pero las
ilimitaciones de sus enlaces de hidrógeno los hace más hidrofóbicos que los
alcoholes o ácidos de los que derivan. Esta falta de capacidad de actuar como
donador de enlace de hidrógeno ocasiona el que no pueda formar enlaces de
hidrógeno entre moléculas de ésteres,
lo que los hace más volátiles que un ácido o alcohol de similar peso molecular.
Muchos ésteres tienen un aroma
característico, lo que hace que se utilicen ampliamente como sabores y
fragancias artificiales. Por ejemplo:
·
Acetato de 2 Etil Hexilo: olor a dulzón suave
·
butanoato de metilo: olor a Piña
·
salicilato de metilo (aceite de siempreverde o menta): olor
de las pomadas Germolene™ y Ralgex™ (Reino Unido)
·
octanoato de heptilo: olor
a frambuesa
·
etanoato de isopentilo:
olor a plátano
·
pentanoato de pentilo:
olor a manzana
·
butanoato de pentilo: olor a pera o a albaricoque
·
etanoato de octilo: olor a naranja.
Los ésteres también participan en la hidrólisis esterárica: la ruptura de un éster por agua. Los ésteres también
pueden ser descompuestos por ácidos o bases fuertes. Como resultado, se
descomponen en un alcohol y un ácido carboxílico, o una sal de un ácido carboxílico:
BIBLIOGRAFÍA






































No hay comentarios.:
Publicar un comentario